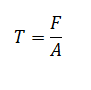فروپاشی پل میتواند از طریق تعدادی از مسیرها رخ دهد. این به احتمال زیاد زمانی اتفاق میافتد که پل دارای ولتاژ عامل میباشد و یا ولتاژ اعمال شده، کمتر از مقدار لازم است. فروپاشی معمولا از طریق کاهش قطر رخ میدهد، تا زمانی که به یک مقدار بحرانی برسد و ناپایداری رخ دهد. حالت دیگری از اختلال پل بطور معمول تنها در پیکربندی افقی رخ میدهد، زمانی که قطر پل بیش از حد بزرگ میشود و رو به پایین است. این رفتار می تواند به نوسانات پل منجر شود و ممکن است باعث از بی ثباتی شود. پل های بزرگ میتوانند به عنوان یک نتیجه از فشار بیش از حد دیده شوند که منجر به وضعیت سرریز می شود؛ روش دیگر افزایش ولتاژ در مقادیر بالا میباشد. این پل های بزرگ قطور همچنین میتواند رو به پایین باشد و منجر به شکست گرانش شوند.